https://www.bbc.com/ – Más de 10 potenciales vacunas contra el coronavirus ya se encuentran en la Fase III de sus ensayos clínicos, la última etapa antes de la aprobación por parte de las agencias reguladoras.
La efectividad se midió utilizando a los 170 voluntarios de los ensayos clínicos de Fase III que fueron diagnosticados con covid-19, pues al comparar los resultados los científicos constataron que la gran mayoría de participantes infectados pertenecían al grupo al que se le había administrado un placebo, es decir, una sustancia sin efecto terapéutico.
Esto significa que la gran mayoría de voluntarios inmunizados parecen haber sido protegidos del Sars-CoV-2, el coronavirus responsable de la pandemia.
Y aunque el estudio, en el que participan más de 43.000 personas repartidas por Sudáfrica, Alemania, Argentina, Brasil, Estados Unidos y Turquía, continuará durante varios meses, estos hallazgos preliminares servirán para que Pfizer y BioNTech soliciten una autorización de emergencia para su producto a la FDA, la agencia reguladora de los Estados Unidos, «en los próximos días».
La de Pfizer y BioNTech no es la única candidata al borde de la aprobación.
En un comunicado difundido el 16 de noviembre, el laboratorio Moderna informó que su inmunizador había registrado una tasa de efectividad del 94%.
Y esta semana se dieron a conocer los resultados preliminares de la vacuna desarrollada por la Universidad de Oxford y AstraZeneca, que muestran que es un 70,4% efectiva.
Pero, ¿cuáles son las fortalezas y debilidades de cada competidor en esta carrera por una vacuna? Ha llegado el momento de conocerlos.
1. BNT162 (Pfizer y BioNTech)
Por lo que se sabe hasta el momento, la vacuna BNT162 es una de las más avanzadas y debería ser aprobada por Estados Unidos en las próximas semanas.
Esta utiliza la tecnología conocida como ARN: es decir, contiene una pequeña secuencia genética creada en el laboratorio que «enseña» a las propias células del cuerpo humano a producir proteínas similares a Sars-CoV-2. A partir de ahí, el sistema inmunológico reconoce la amenaza y crea una respuesta que protege al cuerpo de futuras infecciones.
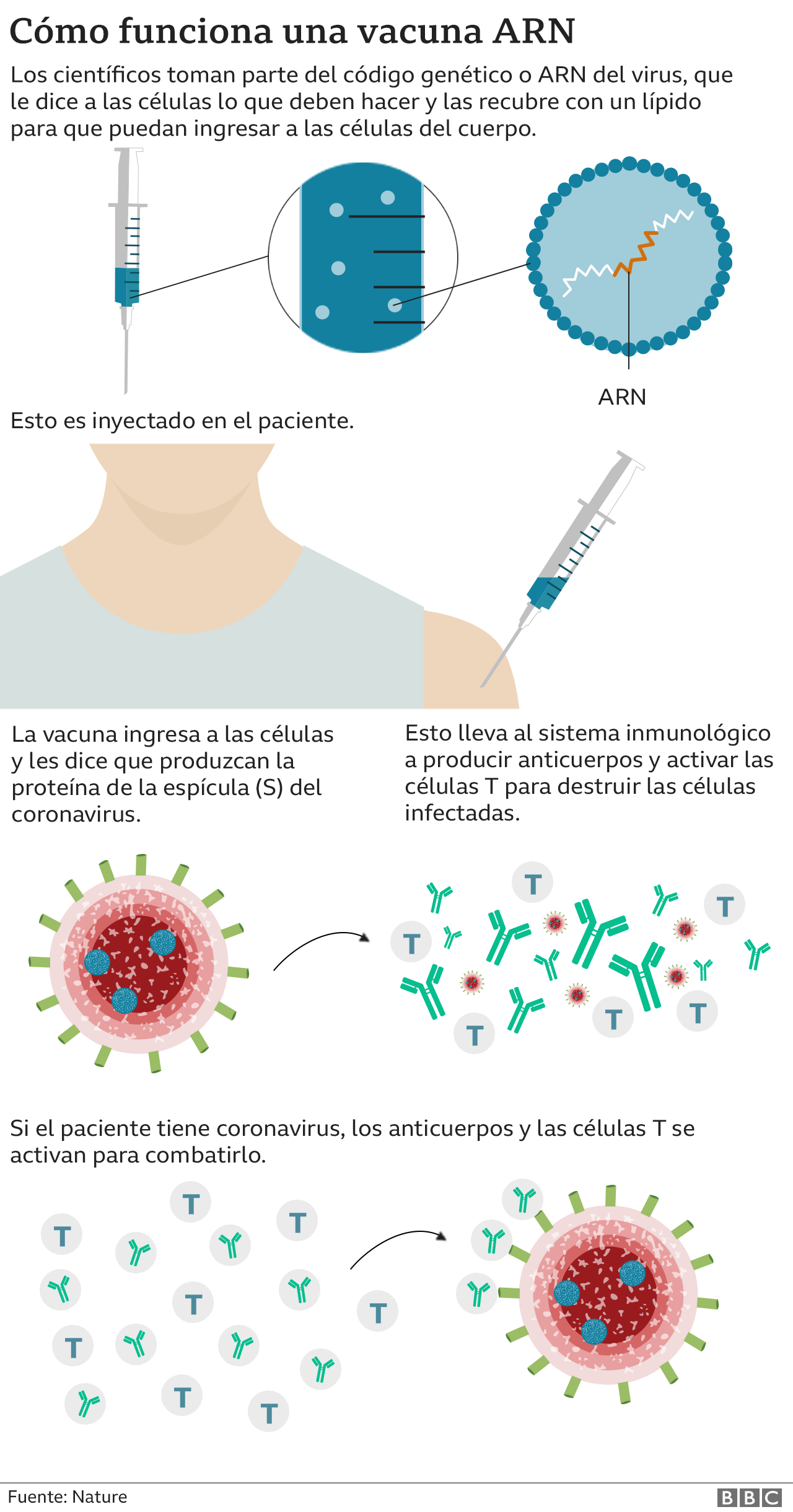
Cabe destacar que los resultados anunciados por Pfizer y BioNTech aún necesitan ser publicados en alguna revista científica y evaluados por expertos independientes.
Pero si son consistentes, representarán un cambio de paradigma en la ciencia, pues la suya sería la primera vacuna genética de la historia.
¿Cuál es la ventaja de esto? Primero, son mucho más fáciles y rápidas de producir. Luego, los requisitos de laboratorio y equipo son menores en comparación con los inmunizadores que tenemos hasta ahora.
Pero el mayor inconveniente es la necesidad de mantener las dosis a una temperatura inferior a –70° C para evitar que la sustancia pierda su efecto. Esto puede convertirse en un obstáculo importante en regiones remotas o muy cálidas.
En entrevistas recientes, los representantes de Pfizer dijeron que están pensando en soluciones y tecnologías para garantizar una temperatura tan baja, menor incluso que el más frío invierno en la Antártida.
Otro problema sería la disponibilidad de este inmunizador en los países en desarrollo.
Por ahora, por ejemplo, y a pesar de la participación de Brasil en las pruebas, no existe ningún arreglo para la compra o transferencia de tecnología al país. E incluso si el gobierno brasileño y las dos empresas cierran un acuerdo, las primeras dosis solo llegarían a Brasil a partir del primer trimestre de 2021, pues otras naciones ya se han garantizado los primeros lotes.
2. mRNA-1273 (Moderna)
Esta candidata también forma parte del grupo de vacunas basadas en ARN. El reciente anuncio de Moderna, por su parte, se basó en 95 participantes en ensayos clínicos diagnosticados con covid-19. Los resultados muestran que 90 de ellos eran del grupo placebo, lo que sugiere una tasa de efectividad del 94%.
También hay otras buenas noticias relacionadas con esta primer informe: el inmunizador no causó ningún evento adverso notable y generó una respuesta constante del sistema inmunológico incluso en los ancianos o en personas con enfermedades crónicas. También parece prevenir casos graves que requieren hospitalización e intubación.
Antes de solicitar la aprobación, sin embargo, el fabricante de medicamentos debe esperar un poco más para completar el objetivo de 150 eventos (es decir, 150 participantes infectados de covid-19) para tener datos más sólidos. Esto debería suceder en las próximas semanas.
Comparado con el competidor Pfizer y BioNTech, el producto de Moderna tiene la ventaja de almacenarse a menos de 20° C. Esta es una temperatura mucho más fácil de garantizar con los congeladores que tenemos actualmente.
No hay mucha información sobre la posible llegada de esta vacuna a los países en desarrollo. Una forma de obtener el producto puede ser el Fondo Global de Acceso a Vacunas para Covid-19 (Covax), creado por la Organización Mundial de la Salud con el objetivo de distribuir dosis a países menos desarrollados. Numerosos países latinoamericanos son parte de esta iniciativa.
3. AZD1222 (Universidad de Oxford y AstraZeneca)
También probada en Brasil, esta candidata pertenece al equipo de vacunas de vectores virales no replicantes.
Esto quiere decir que se construyó a partir de un adenovirus, un tipo de virus que no daña nuestra salud. En su interior, los científicos insertaron algunos genes de Sars-CoV-2 para provocar una reacción del sistema inmunológico.
A la vacuna le ha ido bien en ensayos clínicos: la información completa del estudio de Fase II se publicó el 19 de noviembre en The Lancet y confirmó que el inmunizador es seguro y no causa efectos secundarios graves, incluso en ancianos. Otro punto a destacar es que produjo anticuerpos, una gran señal.
El 23 de noviembre, los desarrolladores de la vacuna divulgaron los resultados preliminares de la Fase III de ensayos clínicos.
De acuerdo al análisis de 131 casos de covid-19, esta vacuna demostró ser un 70,4% efectiva al combinar datos obtenidos de un régimen de dos dosis administradas. Los investigadores estiman, sin embargo, que dicha eficacia pueda llegar al 90% si se ajusta la dosis.

Las fortalezas y debilidades de AZD1222 están en su originalidad: hasta el momento, no existe una vacuna aprobada que utilice este tipo de metodología. Por un lado, esto puede funcionar y revolucionar el conocimiento en el campo. Por otro, es necesario esperar pacientemente los resultados definitivos sobre la efectividad y seguridad del producto.
Una ventaja de la vacuna de la Universidad de Oxford y AstraZeneca está en su disponibilidad. Entre otros, Brasil, Argentina y México ya tienen convenios para la compra y transferencia de tecnología.
A nivel mundial, los responsables de esta vacuna garantizan que tendrán capacidad para entregar 3.000 millones de unidades en 2021.
Otra ventaja de este compuesto es que puede guardarse a una temperatura de entre 2 y 8 °C, por lo cual puede distribuirse y preservarse con capacidades logísticas existentes.
4. CoronaVac (Sinovac)
Esta vacuna china copó titulares la semana pasada, luego de la suspensión de las pruebas clínicas en Brasil por la muerte de un voluntario. La Agencia Nacional de Vigilancia Sanitaria (Anvisa) y el Instituto Butantan intercambiaron críticas en una serie de notas y entrevistas colectivas.
Pero pocos días después se aclaró que la muerte no había tenido nada que ver con la vacuna y se retomó el estudio con normalidad.
Dejando a un lado la polémica, la farmacéutica Sinovac también apuesta por la estrategia del virus inactivado. Los científicos utilizaron algún método, como calor o productos químicos, para desactivar el Sars-CoV-2 y que no cause infección ni se reproduzca dentro del cuerpo. Aun así, cuando se aplica en una vacuna, el virus es reconocido por el sistema inmunológico, creando una respuesta protectora.
El punto fuerte aquí es la fiabilidad. La ciencia ha estado trabajando con vacunas de virus inactivados durante casi siete décadas. Por eso ya sabemos muy bien cómo producirlas y los principales problemas que pueden aparecer por el camino.
En la dirección opuesta, el punto débil es el retraso. La fabricación requiere un rigor extremadamente alto y una planta industrial muy bien equipada. La formulación tampoco rinde mucho en dosis por litro.
El producto se encuentra en la Fase III de prueba y pronto espera completar la cantidad mínima de eventos (voluntarios infectados con covid-19) para calcular su tasa de efectividad, como sucedió recientemente con Pfizer / BioNTech y Moderna.
La refrigeración no parece ser un problema, ya que otras vacunas de virus inactivados pueden guardarse en un refrigerador convencional.
Otro punto positivo es el acuerdo entre Sinovac y el Instituto Butantan, en São Paulo, que debería facilitar el acceso a CoronaVac en Brasil y América Latina.
5. Sputnik V (Centro Gamalaya de Investigación en Epidemiología y Microbiología)
Durante mucho tiempo, la palabra que mejor definió a la vacuna Sputnik V fue misterio. Las primeras noticias de Rusia, donde se encuentra el Instituto de Investigación Gamalaya, decían que ya se encontraba en una etapa avanzada de investigación. Poco después, fue aprobada por el gobierno.
Los especialistas estaban muy preocupados porque las pruebas clínicas que garantizan la confiabilidad del proceso de investigación no habían sido registradas ni publicadas en ninguna revista científica.
Desde entonces, ha surgido mucha información: la vacuna se basa en el vector viral no replicante (del mismo tipo en la Universidad de Oxford / AstraZeneca) y se está probando en unos 40.000 voluntarios en países como Rusia, Emiratos Árabes Unidos, Venezuela y Bielorrusia.
Con base en uno de estos análisis preliminares, los investigadores de la Sputnik V anunciaron una efectividad del 92%, basándose en 20 eventos registrados. Hay que esperar a que el estudio evolucione un poco más para que este ritmo se consolide.
Se especula que el inmunizador no requiere congelación, pero esa información aún no se ha confirmado.
6. JNJ-78436735 (Johnson & Johnson)
Sudáfrica, Argentina, Brasil, Chile, Colombia, Estados Unidos, México y Perú son los países donde actualmente se prueba la vacuna de Johnson & Johnson. Hay más de 60 mil voluntarios en estos países.
Basada en la tecnología del vector viral no replicante (el mismo utilizado por la Universidad de Oxford / AstraZeneca y la Sputnik V), parece estar un poco retrasada, ya que la farmacéutica no ha hecho anuncios de análisis preliminares. Se espera que suceda en las próximas semanas.
La principal ventaja estaría en los números: parte de los estudios de Fase III evalúa una sola aplicación de la vacuna. Los otros competidores necesitan dos dosis para tener efecto. Si este esquema funciona, podría significar ahorros de miles de millones de dólares.
7. NVX-CoV2373 (Novavax)
Este es el representante más avanzado de la clase de vacunas de subunidades de proteínas. En lugar de utilizar todo el virus, se desarrolló a partir de un pequeño fragmento de Sars-CoV-2 capaz de activar una respuesta inmunitaria.
En relación con los competidores enumerados anteriormente, el desempeño de Novavax tardará más en conocerse. Parte de los estudios de Fase III se llevan a cabo en el Reino Unido con 15.000 voluntarios y se esperan resultados preliminares en enero o febrero de 2021.
Hay otra parte de esta investigación que se realizará con decenas de miles de participantes en Estados Unidos. Se espera que la etapa comience a fines de noviembre o principios de diciembre.
Como el producto de Novavax es parte de Covax (ese consorcio de la OMS para la compra y distribución de dosis a países menos desarrollados), es posible que llegue a América Latina en algún momento, si todo va bien.
8. Ad5-nCoV (CanSino)
También elaborada a partir de un vector viral que no se replica (como los candidatos de la Universidad de Oxford / AstraZeneca, Sputnik V y Johnson & Johnson), fue aprobada de emergencia para su uso por personal militar chino, incluso antes de importantes estudios de seguridad y eficacia.
En las pruebas de Fase III, la Ad5-nCoV se aplica actualmente a más de 40.000 voluntarios de Pakistán, Arabia Saudita y México.
Hay poca información sobre esta vacuna así que es necesario esperar nuevos anuncios por parte de los responsables.
9. Covaxin (Bharat Biotech)
Desarrollada en India, es una de las últimas candidatas en entrar en la Fase III de ensayos clínicos. Al igual que CoronaVac, también utiliza virus inactivados en su formulación.
Como se mencionó anteriormente, existe una gran experiencia mundial en el uso de esta tecnología, aunque es costosa y requiere mucho tiempo en comparación con los métodos más modernos.
Para los ensayos, los responsables pretenden reclutar a más de 25.000 participantes en territorio indio. Según un informe de Reuters, se espera que la distribución de dosis comience a partir de febrero de 2021.
Pronto se darán a conocer más detalles sobre Covaxin.
Consulte la noticia original en: https://www.bbc.com/
[:en]https://www.bbc.com/ – More than 10 potential coronavirus vaccines are already in Phase III of their clinical trials, the last stage before approval by regulatory agencies.
Effectiveness was measured using the 170 volunteers from the Phase III clinical trials who were diagnosed with covid-19, because when comparing the results, the scientists found that the vast majority of infected participants belonged to the group to which a placebo had been administered, that is, a substance with no therapeutic effect.
This means that most immunized volunteers appear to have been protected from Sars-CoV-2, the coronavirus responsible for the pandemic.
And although the study, which involves more than 43,000 people spread across South Africa, Germany, Argentina, Brazil, the United States and Turkey, will continue for several months, These preliminary findings will help Pfizer and BioNTech apply for emergency authorization for their product from the US regulatory agency, FDA, «in the coming days’.
Pfizer and BioNTech is not the only candidate on the verge of approval.
In a statement released on November 16, the Moderna laboratory reported that its immunizer had recorded an effectiveness rate of 94%.
And this week were released the preliminary results of the vaccine developed by the University of Oxford and AstraZeneca, which show that it is 70.4% effective.
But what are the strengths and weaknesses of each competitor in this vaccine race? The time has come to get to know them.
-
BNT162 (Pfizer and BioNTech)
As far as is known, the BNT162 vaccine is one of the most advanced and should be approved by the United States in the coming weeks.
It uses the technology known as RNA: that is, it contains a small genetic sequence created in the laboratory that «teaches’ the human body’s own cells to produce proteins similar to Sars-CoV-2. From there, the immune system recognizes the threat and creates a response that protects the body from future infections.

It should be noted that the results announced by Pfizer and BioNTech still need to be published in a scientific journal and evaluated by independent experts.
But if they are consistent, they will represent a paradigm shift in science, because theirs would be the first genetic vaccine in history.
What is the advantage of this? First, they are much easier and faster to produce. Then, lab and equipment requirements are lower than the immunizers we have so far.
But the biggest drawback is the need to keep doses below -70°C to prevent the substance from losing its effect. This can become a major obstacle in remote or very hot regions.
In recent interviews, Pfizer representatives said they are thinking about solutions and technologies to ensure such a low temperature, less than even the coldest winter in Antarctica.
Another problem would be the availability of this immunizer in developing countries.
For now, for example, and despite Brazil’s participation in the tests, there is no arrangement for the purchase or transfer of technology to the country. And even if the Brazilian government and the two companies close an agreement, the first doses would only reach Brazil from the first quarter of 2021, as other nations have already secured the first lots.
-
mRNA-1273 (Moderna)
This candidate is also part of the RNA-based vaccine group. Moderna’s recent announcement, on the other hand, was based on 95 participants in clinical trials diagnosed with covid-19. The results show that 90 of them were in the placebo group, suggesting an effectiveness rate of 94%.
There is also other good news related to this first report: the immunizer did not cause any noticeable adverse events and generated a consistent immune system response even in the elderly or in people with chronic diseases. It also appears to prevent serious cases requiring hospitalization and intubation.
Before applying for approval, however, the drug manufacturer should wait a little longer to complete the target of 150 events (i.e., 150 participants infected with covid-19) to have more solid data. This should happen in the coming weeks.
Compared to competitor Pfizer and BioNTech, Moderna’s product has the advantage of being stored at less than 20°C. This is a much easier temperature to guarantee with the freezers we currently have.
There is not much information about the possible arrival of this vaccine in developing countries. One way to obtain the product may be the Global Vaccine Access Fund for Covid-19 (Covax), created by the World Health Organization to distribute doses to less developed countries. Many Latin American countries are part of this initiative.
-
AZD1222 (Oxford University and AstraZeneca)
Also tested in Brazil, this candidate belongs to the vaccine team of non-replicating viral vectors.
This means that it was built from an adenovirus, a type of virus that does not harm our health. Inside, scientists inserted some Sars-CoV-2 genes to trigger an immune system reaction.
The vaccine has done well in clinical trials: the complete information from the Phase II study was published on November 19 in The Lancet and confirmed that the immunizer is safe and does not cause serious side effects, even in the elderly. Another point to note is that it produced antibodies, a great signal.
On November 23, vaccine developers released preliminary results from Phase III clinical trials.
According to the analysis of 131 cases of covid-19, this vaccine proved to be 70.4% effective by combining data obtained from a two-dose regimen. The researchers estimate, however, that this efficacy can reach 90% if the dose is adjusted.

The strengths and weaknesses of AZD1222 are in their originality: so far, there is no approved vaccine that uses this type of methodology. On the one hand, this can work and revolutionize knowledge in the field. On the other hand, it is necessary to wait patiently for the definitive results on the effectiveness and safety of the product.
An advantage of the vaccine of the University of Oxford and AstraZeneca is in its availability. Among others, Brazil, Argentina and Mexico already have agreements for the purchase and transfer of technology.
Globally, those responsible for this vaccine guarantee that they will have the capacity to deliver 3 billion units by 2021.
Another advantage of this compound is that it can be stored at a temperature between 2 and 8°C, so it can be distributed and preserved with existing logistics capabilities.
-
CoronaVac (Sinovac)
This Chinese vaccine made headlines last week, following the suspension of clinical trials in Brazil for the death of a volunteer. The National Sanitary Surveillance Agency (Anvisa) and the Butantan Institute exchanged criticisms in a series of notes and collective interviews.
But a few days later it became clear that the death had nothing to do with the vaccine and the study was resumed normally.
Aside from the controversy, pharmaceutical company Sinovac is also committed to the strategy of inactivated virus. Scientists used some method, such as heat or chemicals, to disable Sars-CoV-2 that does not cause infection or reproduce within the body. However, when applied in a vaccine, the virus is recognized by the immune system, creating a protective response.
The strong point here is reliability. Science has been working with inactivated virus vaccines for almost seven decades. That is why we already know very well how to produce them and the main problems that may arise along the way.
In the opposite direction, the weak point is delay. Manufacturing requires extremely high rigor and a well-equipped industrial plant. The formulation also does not yield much in doses per liter.
The product is in Phase III testing and soon expects to complete the minimum number of events (covid-19 infected volunteers) to calculate its effectiveness rate, as was recently the case with Pfizer / BioNTech and Moderna.
Refrigeration does not seem to be a problem, as other inactivated virus vaccines can be stored in a conventional refrigerator.
Another positive point is the agreement between Sinovac and the Butantan Institute in São Paulo, which should facilitate access to CoronaVac in Brazil and Latin America.
-
Sputnik V (Gamalaya Research Centre for Epidemiology and Microbiology)
For a long time, the word that best defined the Sputnik V vaccine was a mystery. The first news from Russia, where the Gamalaya Research Institute is located, said that it was already at an advanced stage of research. Soon after, it was approved by the government.
The specialists were very concerned that the clinical tests that guarantee the reliability of the research process had not been registered or published in any scientific journal.
Since then, much information has emerged: the vaccine is based on the non-replicating viral vector (of the same type at Oxford University / AstraZeneca) and is being tested on some 40,000 volunteers in countries such as Russia, the United Arab Emirates, Venezuela and Belarus.
Based on one of these preliminary analyses, Sputnik V researchers announced a 92% effectiveness, based on 20 recorded events. It is necessary to wait for the study to evolve a little further before this rhythm is consolidated.
It is speculated that the immunizer does not require freezing, but that information has not yet been confirmed.
-
JNJ-78436735 (Johnson & Johnson)
South Africa, Argentina, Brazil, Chile, Colombia, the United States, Mexico and Peru are the countries where the Johnson & Johnson vaccine is currently being tested. There are over 60,000 volunteers in these countries.
Based on non-replicating viral vector technology (the same used by Oxford University / AstraZeneca and Sputnik V), it appears to be a little behind schedule, as the pharmaceutical company has not made preliminary analysis announcements. It is expected to happen in the coming weeks.
The main advantage would be in numbers: part of the Phase III studies evaluates a single vaccine application. The other competitors need two doses to take effect. If this scheme works, it could mean savings of billions of dollars.
-
NVX-CoV2373 (Novavax)
This is the most advanced representative of the protein subunit vaccine class. Instead of using the entire virus, it was developed from a small fragment of Sars-CoV-2 capable of activating an immune response.
In relation to the competitors listed above, it will take longer for Novavax’s performance to be known. Part of the Phase III studies are carried out in the UK with 15,000 volunteers and preliminary results are expected in January or February 2021.
There is another part of this research that will be done with tens of thousands of participants in the United States. The phase is expected to start in late November or early December.
Since Novavax’s product is part of Covax (that WHO consortium for the purchase and distribution of doses to less developed countries), it may reach Latin America at some point, if all goes well.
-
Ad5-nCoV (CanSino)
Also crafted from a non-replicating viral vector (such as candidates from Oxford University / AstraZeneca, Sputnik V and Johnson & Johnson), it was approved for emergency use by Chinese military personnel, even before major safety and efficacy studies.
In Phase III testing, Ad5-nCoV currently applies to more than 40,000 volunteers from Pakistan, Saudi Arabia and Mexico.
There is little information about this vaccine, so it is necessary to expect new announcements from those responsible.
-
Covaxin (Bharat Biotech)
Developed in India, it is one of the last candidates to enter Phase III clinical trials. Like CoronaVac, it also uses inactivated viruses in its formulation.
As mentioned above, there is a great deal of global experience in the use of this technology, although it is costly and time-consuming compared to more modern methods.
For the trials, those responsible intend to recruit more than 25,000 participants in Indian territory. According to a report by Reuters, the distribution of doses is expected to start from February 2021.
More details about Covaxin will be released soon.
For the original article see: https://www.bbc.com/
[:pb]https://www.bbc.com/ – Mais de 10 vacinas potenciais contra o coronavírus já estão na Fase III de seus testes clínicos, a última etapa antes da aprovação das agências reguladoras.
A eficácia foi medida usando 170 voluntários dos ensaios clínicos de Fase III que foram diagnosticados com covid-19, pois ao comparar os resultados, os cientistas descobriram que a grande maioria dos participantes infectados pertencia ao grupo que havia recebido um placebo, ou seja, uma substância sem efeito terapêutico.
Isso significa que a grande maioria dos voluntários imunizados parece ter sido protegida do Sars-CoV-2, o coronavírus responsável pela pandemia.
E embora o estudo, envolvendo mais de 43.000 pessoas na África do Sul, Alemanha, Argentina, Brasil, Estados Unidos e Turquia, deva continuar por vários meses, essas descobertas preliminares levarão a Pfizer e a BioNTech a solicitar um autorização de emergência para o seu produto ao FDA, a agência reguladora dos Estados Unidos “nos próximos dias”.
A Pfizer e a BioNTech não são as únicas candidatas próximas à aprovação.
Em nota divulgada no dia 16 de novembro, o laboratório Moderna relatou que seu imunizante registrou uma taxa de eficácia de 94%.
E nesta semana foram divulgados os resultados preliminares da vacina desenvolvida pela Universidade de Oxford e AstraZeneca, mostrando que é 70,4% eficaz.
Mas quais são os pontos fortes e fracos de cada competidor nesta corrida por uma vacina? Chegou a hora de conhecê-los.
- BNT162 (Pfizer e BioNTech)
Pelo que se sabe até agora, a vacina BNT162 é uma das mais avançadas e deve ser aprovada pelos Estados Unidos nas próximas semanas.
Ela usa a tecnologia conhecida como RNA: isto é, contém uma pequena sequência genética criada em laboratório que “ensina” as células, do próprio corpo humano, a produzir proteínas semelhantes ao Sars-CoV-2. A partir daí, o sistema imunológico reconhece a ameaça e cria uma resposta que protege o corpo contra infecções futuras.

Vale a pena ressaltar que os resultados anunciados pela Pfizer e BioNTech ainda precisam ser publicados em alguma revista científica e avaliados por especialistas independentes.
Mas se forem consistentes, representarão uma mudança de paradigma na ciência, já que essa seria a primeira vacina genética da história.
Qual a vantagem disso? Primeiro, elas são muito mais fáceis e rápidas de produzir. Então, os requisitos de laboratório e equipamento são menores em comparação com os imunizantes que temos até agora.
Mas a maior desvantagem é a necessidade de manter as dosagens em uma temperatura abaixo de –70 ° C para evitar que a substância perca seu efeito. Isso pode se tornar um grande obstáculo em regiões remotas ou muito quentes.
Em entrevistas recentes, os representantes da Pfizer disseram estar pensando em soluções e tecnologias para garantir uma temperatura tão baixa, inferior até mesmo ao inverno mais frio da Antártica.
Outro problema seria a disponibilidade deste imunizante em países em desenvolvimento.
Por enquanto, por exemplo, e apesar da participação do Brasil nos testes, não há acordo para compra ou transferência de tecnologia para o país. E mesmo que o governo brasileiro e as duas empresas fechem um acordo, as primeiras doses só chegariam ao Brasil a partir do primeiro trimestre de 2021, pois outras nações já garantiram os primeiros lotes.
- mRNA-1273 (Moderna)
Essa candidata também faz parte do grupo de vacinas baseadas em RNA. O anúncio recente da Moderna, entretanto, foi baseado em 95 participantes de ensaios clínicos com diagnóstico de Covid-19. Os resultados mostram que 90 deles eram do grupo placebo, sugerindo uma taxa de eficácia de 94%.
Há também outra boa notícia relacionada a este primeiro relato: o imunizante não causou nenhum evento adverso notável e gerou uma resposta constante do sistema imunológico mesmo em idosos ou em pessoas com doenças crônicas. Também parece prevenir casos graves que requerem hospitalização e intubação.
Antes de solicitar a aprovação, no entanto, o fabricante do medicamento deve esperar um pouco mais para completar a meta de 150 eventos (ou seja, 150 participantes infectados com covid-19) para ter dados mais robustos. Isso deve acontecer nas próximas semanas.
Comparado com os concorrentes Pfizer e BioNTech, o produto da Moderna tem a vantagem de ser armazenado abaixo de 20°C. Esta é uma temperatura muito mais fácil de garantir com os freezers que temos atualmente.
Não há muitas informações sobre a possível chegada desta vacina para países em desenvolvimento. Uma forma de obter o produto pode ser o Fundo Global de Acesso a Vacinas para Covid-19 (Covax), criado pela Organização Mundial de Saúde com o objetivo de distribuir doses a países menos desenvolvidos. Muitos países latino-americanos fazem parte desta iniciativa.
- AZD1222 (Universidade de Oxford e AstraZeneca)
Também testado no Brasil, esta candidata pertence à equipe de vacinas de vetores virais não replicantes.
Isso significa que foi construída a partir de um adenovírus, um tipo de vírus que não faz mal à saúde. Dentro dele, os cientistas inseriram alguns genes Sars-CoV-2 para provocar uma reação do sistema imunológico.
A vacina teve um bom desempenho em ensaios clínicos: as informações completas do estudo de Fase II foram divulgadas em 19 de novembro na The Lancet e confirmou que o imunizante é seguro e não causa efeitos colaterais graves, mesmo em idosos. Outro destaque é que produziu anticorpos, um ótimo sinal.
No dia 23 de novembro, os desenvolvedores da vacina divulgaram os resultados preliminares dos testes clínicos de Fase III.
De acordo com a análise de 131 casos de covid-19, esta vacina provou ser 70,4% eficaz combinando dados obtidos a partir de um regime de duas doses administrado. Os pesquisadores estimam, no entanto, que essa eficácia pode chegar a 90% se a dose for ajustada.
Os pontos fortes e fracos da AZD1222 estão em sua originalidade: até o momento, não existe uma vacina aprovada que utilize esse tipo de metodologia. Por um lado, isso pode funcionar e revolucionar o conhecimento na área. Por outro lado, é necessário aguardar com paciência os resultados definitivos sobre a eficácia e segurança do produto.
Uma vantagem da vacina da Universidade de Oxford e AstraZeneca está na sua disponibilidade. Entre outros, Brasil, Argentina e México já possuem acordos de compra e transferência de tecnologia.
No mundo todo, os responsáveis por essa vacina garantem que terão capacidade para entregar 3 bilhões de unidades em 2021.
Outra vantagem deste composto é que pode ser armazenada entre 2 e 8°C, para que possa ser distribuído e preservado com os recursos logísticos existentes.
- CoronaVac (Sinovac)
A vacina chinesa ganhou destaque na semana passada, após a suspensão dos ensaios clínicos no Brasil devido à morte de um voluntário. A Agência Nacional de Vigilância Sanitária (Anvisa) e o Instituto Butantan trocaram críticas em uma série de notas e entrevistas coletivas.
Mas alguns dias depois, ficou claro que a morte não teve nada a ver com a vacina e o estudo foi retomado normalmente.
Deixando de lado a polêmica, a farmacêutica Sinovac também aposta na estratégia do vírus inativado. Os cientistas usaram alguns métodos, como calor ou produtos químicos, para desativar o Sars-CoV-2 de forma que ele não causasse infecção ou se reproduzisse dentro do corpo. Ainda assim, quando aplicado em uma vacina, o vírus é reconhecido pelo sistema imunológico, criando uma resposta protetora.
O ponto forte aqui é a confiabilidade. A ciência tem trabalhado com vacinas de vírus inativados por quase sete décadas. É por isso que já sabemos muito bem como os produzir e os principais problemas que podem surgir ao longo do caminho.
Na direção oposta, o ponto fraco é o atraso. A fabricação exige um rigor extremamente alto e uma planta industrial muito bem equipada. A formulação também não rende muito em doses por litro.
O produto está na fase III de teste e em breve espera completar o número mínimo de eventos (voluntários infectados com covid-19) para calcular sua taxa de eficácia, como aconteceu recentemente com a Pfizer / BioNTech e Moderna.
A refrigeração não parece ser um problema, pois outras vacinas de vírus inativadas podem ser armazenadas em um refrigerador convencional.
Outro ponto positivo é o convênio entre a Sinovac e Instituto Butantan, em São Paulo , o que deve facilitar o acesso ao CoronaVac no Brasil e na América Latina.
- Sputnik V (Centro Gamalaya de Pesquisa em Epidemiologia e Microbiologia)
Por muito tempo, a palavra que melhor definia a vacina Sputnik V era mistério. As primeiras notícias da Rússia, onde está localizado o Instituto de Pesquisa Gamalaya, diziam que ela já estava em estágio avançado de pesquisa. Pouco depois, foi aprovada pelo governo.
Os especialistas ficaram muito preocupados com os testes clínicos, que garantem a confiabilidade do processo de pesquisa, por não serem registrados ou publicados em nenhuma revista científica.
Desde então, muitas informações surgiram: a vacina é baseada no vetor viral não replicante (do mesmo tipo na Universidade de Oxford / AstraZeneca) e está sendo testada em cerca de 40.000 voluntários em países como Rússia, Emirados Árabes Unidos, Venezuela e Bielo-Rússia.
Com base em uma dessas análises preliminares, os pesquisadores da Sputnik V anunciaram 92% de eficácia, com base em 20 eventos registrados. Temos que esperar que o estudo evolua um pouco mais para que esse ritmo se consolide.
Especula-se que o imunizante não precise ser congelado, mas essa informação ainda não foi confirmada.
- JNJ-78436735 (Johnson & Johnson)
África do Sul, Argentina, Brasil, Chile, Colômbia, Estados Unidos, México e Peru são os países onde a vacina Johnson & Johnson está sendo testada. São mais de 60 mil voluntários nesses países.
Com base na tecnologia de vetor viral não replicante (a mesma usada pela Universidade de Oxford / AstraZeneca e Sputnik V), parece estar um pouco atrasada, uma vez que a farmacêutica não fez anúncios de análises preliminares. Espera-se que aconteça nas próximas semanas.
A principal vantagem estaria nos números: parte dos estudos da Fase III avaliam uma única aplicação da vacina. Os outros competidores precisam de duas doses para fazer efeito. Se esse esquema funcionar, pode significar uma economia de bilhões de dólares.
- NVX-CoV2373 (Novavax)
Esta é a representante mais avançada da classe de vacinas de subunidades proteicas. Em vez de usar o vírus inteiro, foi desenvolvido a partir de um pequeno fragmento de Sars-CoV-2 capaz de ativar uma resposta imune.
Em relação aos concorrentes listados acima, o desempenho da Novavax demorará mais para se tornar conhecido. Parte dos estudos de Fase III são realizados no Reino Unido com 15.000 voluntários e são esperados resultados preliminares em janeiro ou fevereiro de 2021.
Há outra parte dessa pesquisa que será conduzida com dezenas de milhares de participantes nos Estados Unidos. A previsão é que a etapa comece no final de novembro ou início de dezembro.
Como o produto Novavax faz parte da covax (aquele consórcio da OMS para a compra e distribuição de doses para países menos desenvolvidos), é possível que chegue na América Latina em algum momento, se tudo der certo.
- Ad5-nCoV (CanSino)
Também feita de um vetor viral que não se replica (como os candidatos Sputnik V e Johnson & Johnson da Universidade de Oxford / AstraZeneca), foi aprovada de emergência para uso por militares chineses, mesmo antes de grandes estudos de segurança e eficácia.
No teste de Fase III, Ad5-nCoV é atualmente aplicado a mais de 40.000 voluntários do Paquistão, Arábia Saudita e México.
Existem poucas informações sobre esta vacina, por isso é necessário aguardar novos anúncios dos responsáveis.
- Covaxin (Bharat Biotech)
Desenvolvido na Índia, é uma das mais recentes candidatas a entrar em testes clínicos de Fase III. Como a CoronaVac, ela também usa vírus inativados em sua formulação.
Como mencionado acima, há uma grande experiência mundial no uso desta tecnologia, embora seja cara e demorada em comparação com métodos mais modernos.
Para os ensaios, os responsáveis pretendem recrutar mais de 25.000 participantes em território indiano. De acordo com um relatório da Reuters, a distribuição da dose está prevista para começar em fevereiro de 2021.
Mais detalhes sobre a Covaxin serão divulgados em breve.
Veja a notícia original em: https://www.bbc.com/
[:]