Actualmente los contagios declarados por Covid-19 en todo el mundo superan los 55 millones, mientras que los fallecimientos sobrepasan ya a los 1,3 millones, según los datos que recopila la Universidad Johns Hopkins. Hallar una vacuna contra el nuevo coronavirus se ha convertido en una cuestión de máxima prioridad.
En condiciones normales el desarrollo de una vacuna se extiende durante varios años o incluso décadas, pero en el contexto de la actual pandemia las inversiones financieras y las colaboraciones científicas sin precedentes están modificando los procesos habituales para el desarrollo de vacunas. Esto significa que algunas de las fases del proceso de investigación y desarrollo se realizan de forma paralela, al tiempo que se mantienen estrictas normas clínicas y de seguridad, según la OMS.
Según lo reporta el portal web chequeado, Las vacunas son preparaciones destinadas a generar inmunidad contra una enfermedad estimulando la producción de anticuerpos. Su función es entrenar y preparar a las defensas naturales del organismo (el sistema inmunológico) para detectar y combatir a los virus y las bacterias. Si el cuerpo se ve posteriormente expuesto a estos gérmenes patógenos, estará listo para destruirlos de inmediato, previniendo así la enfermedad.
De acuerdo a RTVE, antes de cualquier prueba clínica en humanos, el candidato a vacuna debe superar una Fase 0 o preclínica, que incluye pruebas in vitro y en animales. La vacuna debe demostrar que es segura y que funciona en los organismos animales. Si lo hace, puede pasar al estudio clínico en seres humanos, que se divide a su vez en tres fases, con una cuarta adicional una vez que el fármaco ya esté autorizado y comercializado:
Fase 1: La vacuna se prueba en pequeños grupos de entre 20 y 100 personas sanas. El estudio se centra en confirmar que es segura y la clase de respuesta inmune que genera, identificando ya posibles efectos secundarios y determinando la dosis adecuada.
Fase 2: Es un estudio a mayor escala en el que participan varios cientos de personas. Aquí se evalúan los efectos secundarios más comunes en el corto plazo y cómo evoluciona el sistema inmune.
Fase 3: Es un ensayo mucho más grande en el que participan varios miles de voluntarios, que ya se exponen al virus. Existe un grupo de control, al que se le administra placebo, y se compara cómo evolucionan las personas que fueron vacunadas respecto a las que no, al mismo tiempo que se recolectan datos estadísticos acerca de la efectividad y la seguridad. También sirve para detectar otros posibles efectos secundarios que hayan pasado desapercibidos en la fase 2.
Fase 4: Las vacunas se someten a una nueva fase de evaluación después de que hayan sido sido aprobadas y comercializadas. El objetivo es seguir recabando información que pueda reforzar su seguridad y eficacia, con una muestra mucho mayor de personas. Aquí pueden aparecer efectos adversos que no se han visto en fases anteriores, precisamente porque son menos frecuentes.
De las 214 vacunas experimentales que hay en marcha contra la COVID-19, la OMS reconoce 164 proyectos que ya han encontrado un candidato a vacuna y se encuentran en fase preclínica. Además, hay otros 48 que la han superado y están en fase clínica, con pruebas en humanos. De ellos, once están en la fase 3, previa a la comercialización:

Reporte de RTVE:
Moderna (Estados Unidos), Fase 3: Esta vacuna está basada en ARN mensajero combinado con el código genético del virus, y España participará en su proceso de producción. Se encuentra ya en fase 3 de ensayos clínicos. La farmacéutica estadounidense acaba de anunciar que tiene una eficacia del 94,5%, según un análisis intermedio realizado por la propia compañía. La biotecnológica solicitará ahora una autorización de emergencia para su uso en Estados Unidos en «las próximas semanas».
BioNTech / Pfizer (Alemania / Estados Unidos). Fase 3: Este candidato a vacuna se encuentra ya en la fase 3; con cuatro variantes, basadas todas ellas en ARN mensajero sintético. Este enfoque múltiple permite realizar una evaluación simultánea para aumentar las posibilidades de identificar al candidato más seguro y eficaz.
Instituto Jenner de la Universidad de Oxford (Reino Unido). Fase 3: En este proyecto, el más importante que se está llevando a cabo en suelo europeo, también participa la farmacéutica AstraZeneca. Utiliza una versión atenuada del virus del resfriado común de los chimpancés, que se caracteriza por su seguridad. Recientemente, se ha conocido que esta vacuna experimental no solo genera una respuesta inmune adecuada en la población joven, sino también en los ancianos, el grupo más vulnerable. Además, que las reacciones adversas han sido incluso más leves entre los voluntarios de mayor edad (en todo caso, en ningún grupo se han constatado hasta ahora efectos graves relacionados con la administración del fármaco).
Janssen / Johnson & Johnson (Estados Unidos). Fase 3: Su vacuna Ad26.COV2-S está basada en un adenovirus recombinante no replicativo que es capaz de generar una respuesta inmunológica frente a la proteína S del coronavirus (de ‘spike’, también llamada «espiga» en español). La compañía cree que, de seguir obteniendo los mismos resultados satisfactorios, puede estar en el mercado a principios de 2021.
Novavax (Estados Unidos). Fase 3: Después de anunciar que su candidato a vacuna ha mostrado respuesta inmune positiva, mientras que apenas ha provocado efectos secundarios en la mayoría de participantes, la compañía biotecnológica estadounidense acaba de comenzar la crítica fase 3 de las pruebas.
Bharat Biotech (India). Fase 3: Bautizada como ‘Covaxine’ esta vacuna experimental que se desarrolla en India, uno de los países más castigados por la pandemia, acaba de comenzar la fase 3 de ensayos clínicos. Este candidato se basa en una cepa inactivada del coronavirus SARS-CoV-2, el causante de la enfermedad COVID-19.
Sinovac (China). Fase 3: Esta propuesta china parte de virus inactivos purificados, y ha generado muchas expectativas. Hace semanas que comenzó la fase 3, después de que Brasil diese el visto bueno para que la compañía inoculase la vacuna experimental a miles de voluntarios del país sudamericano.
Sinopharm / Instituto de Productos Biológicos de Wuhan y Sinopharm / Instituto de Productos Biológicos de Pekín (ambos en China). Fase 3: China también está desarrollando estos dos proyectos independientes entre sí y muy prometedores. Ambos se basan en virus inactivados y detrás de ellos está Sinopharm, el gigante farmacéutico de carácter estatal. También se encuentran en la última fase de ensayos clínicos.
Gamaleya Research Institute (Rusia). Fase 3: Bautizada con el simbólico nombre de ‘Sputnik V’, se trata de una vacuna vectorial combinada, y en su desarrollo también participa el Ministerio de Defensa ruso. La OMS ha reconocido la tercera fase de las pruebas clínicas, pero el Gobierno ruso ha autorizado su administración y la da por desarrollada, después de menos de dos meses de pruebas con voluntarios y sin haber completado los ensayos clínicos.
CanSino Biological Inc. / Instituto de Biotecnologías Pekín (China). Fase 3: Se trata de una vacuna de vector viral. Al ser también de una vacuna de subunidad -una fórmula de nueva generación que no contiene patógenos-, se caracteriza por su seguridad. Debido a las buenas expectativas que está generando, la Oficina Estatal china de Propiedad Intelectual (SIPO, por sus siglas en inglés) ha aprobado su patente, por lo que podría «ser producida en masa en un breve periodo de tiempo». Comenzó a probarse a finales de junio en el Ejército chino. Los resultados de la segunda fase de los ensayos clínicos de la vacuna demostraron que es segura e induce respuesta inmune contra el coronavirus, de acuerdo con una investigación publicada a finales de julio en la revista The Lancet.
El 9 de noviembre, la compañía farmacéutica Pfizer anunció una efectividad en su vacuna de 90% y el 16 de noviembre Moderna en un comunicado afirmó el 94,5% de efectividad en su producto. Esta información corresponde a información preliminar, por lo que faltarían algunos meses para su fabricación y distribución.
Estos anuncios fueron recibidos con entusiasmo a nivel mundial y supone un avance importante en la carrera por la lucha contra la pandemia. Es importante realizar una comparación de estas dos vacunas que utilizan el ARN mensajero para su desarrollo. Según datos suministrados por Bloomberg y La República:
¿Cómo se comparan los resultados?
Moderna dijo el lunes que su vacuna tenía 94,5% de efectividad en un análisis preliminar. Eso se compara favorablemente con el elevado nivel alcanzado una semana antes por Pfizer y su socio, BioNTech SE . Se descubrió que la inyección creada por las empresas estadounidenses y alemanas tenía una eficacia superior a 90%. Los datos de Moderna mostraron que los efectos secundarios fueron generalmente de corta duración y no hubo preocupaciones de seguridad significativas, mientras que no se desarrollaron casos graves de covid entre los participantes del ensayo que recibieron la vacuna. Los reguladores estadounidenses publicaron a principios de este año una guía que decía que cualquier disparo debería tener al menos 50% de efectividad.
¿Qué tienen en común las dos vacunas?
Ambas inyecciones se basan en una tecnología llamada ARN mensajero que nunca antes se había utilizado para desarrollar una vacuna aprobada. El enfoque está diseñado para transformar las propias células del cuerpo en fábricas de fabricación de vacunas. Las vacunas instruyen a las células a hacer copias de la proteína de pico del coronavirus, estimulando la creación de anticuerpos protectores.
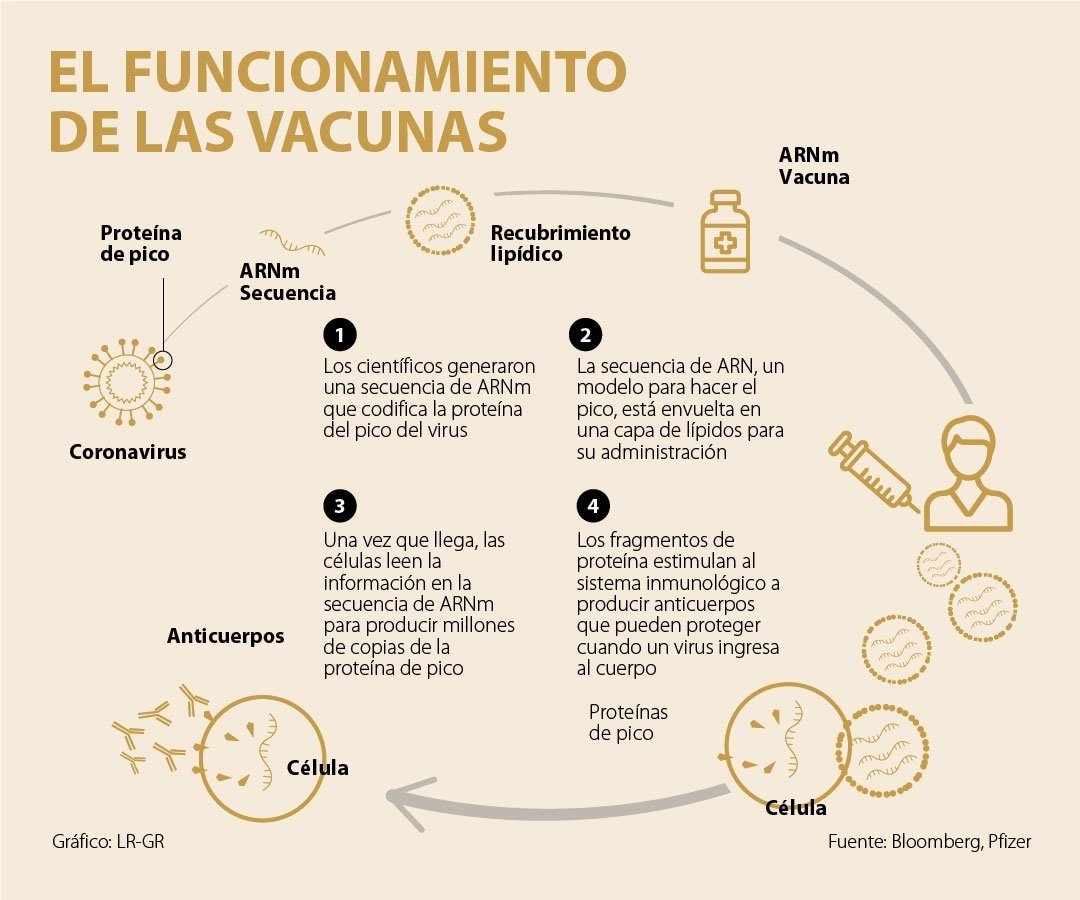
¿En qué se diferencian?
Moderna recibió US$ 955 millones del programa Operation Warp Speed de Estados Unidos. Pfizer ha dicho que no recibió ningún financiamiento federal para desarrollar su vacuna, aunque BioNTech obtuvo hasta 375 millones de euros (US$444 millones) en ayuda del gobierno alemán. Aún así, Pfizer ha llegado a un acuerdo de suministro con EE. UU. Por valor de casi US$ 2.000 millones. Estados Unidos acordó pagar hasta US$ 1.530 millones para comprar suministros de la toma Moderna.
¿Cuáles son los desafíos de almacenamiento y distribución?
Una vez aprobadas las vacunas, el esfuerzo por inmunizar a cientos de millones de personas deberá superar una serie de obstáculos más. El almacenamiento y distribución de algunos de los productos es complejo. La vacuna de Pfizer debe almacenarse ultra fría hasta unos días antes de su uso, pero puede mantenerse a temperatura del refrigerador hasta por cinco días. Moderna, por su parte, señaló nuevos datos que muestran que su vacuna es estable a la temperatura del refrigerador durante 30 días, mucho más que los siete días estimados anteriormente. Se puede conservar en congeladores a más largo plazo y no necesita las instalaciones especiales necesarias para la vacuna Pfizer.
¿Cuándo podrían estar listos para desplegarse?
Los resultados son preliminares, pero se espera que tanto Moderna como Pfizer soliciten la autorización de uso de emergencia de la Administración de Drogas y Alimentos de los EE.UU. Si una revisión adicional demuestra que sus vacunas son seguras. Moderna dijo que podría solicitar la autorización de los reguladores en las próximas semanas. Pfizer espera obtener dos meses de datos de seguimiento de seguridad en la tercera semana de noviembre. Si todo va bien, Pfizer podría solicitar una autorización en los EE.UU. este mes.
La Distribución de las vacunas y el desafío a la logística
Si las vacunas se aprueban para su uso generalizado de acuerdo a The Economist, el mundo enfrentará lo que algunos han llamado el mayor desafío de la cadena de suministro de la historia.
Pfizer dice que solo podrá producir suficiente vacuna para inocular a 25 millones de personas en 2020. Hasta 1.300 millones de dosis son posibles, en teoría, el próximo año, suficiente para otros 650 millones de personas. Moderna dijo que tendría 20 millones de dosis listas para fines de 2020 y entre 500 a 1000 millones en 2021 . Si se aprueban otras vacunas, el suministro aumentará. Sin embargo, incluso en los escenarios más optimistas se espera que la demanda supere la oferta a lo largo de 2021.
La entrega de vacunas COVID-19 a 7.800 millones de personas es un desafío abrumador que hará que las cadenas de suministro superen sus límites. Incluso si todas las dosis necesarias estuvieran listas hoy, los fabricantes de vacunas aún deben encontrar soluciones para administrar múltiples dosis de esas vacunas a la mayoría de las personas en el planeta.
La entrega de la última milla es el mayor obstáculo. A medida que los cargamentos de vacunas se dividen en unidades más pequeñas para su envío a hospitales, clínicas, farmacias y consultorios médicos, resulta cada vez más difícil garantizar la estabilidad de la temperatura a lo largo del tiempo.
La vacuna de Pfizer, por sus características, esta obligada a ser mantenida a temperaturas tan frías como los -70º hasta el momento de su inyección. Una situación que determinaría un problema a la hora de su distribución, debido a que la molécula de la vacuna es muy frágil y la más leve interrupción de la cadena de frío puede afectar su efectividad.
Por su parte, la vacuna Moderna sería mucho más fácil de conservarse y distribuir a los diferentes países para empezar la vacunación a la población. La farmacéutica informa que su vacuna ‘mRNA-1273’ puede mantenerse “entre los 2° y los 8°, la temperatura de un refrigerador doméstico estándar, durante 30 días”. Incluso aseguran que puede conservarse a -20ºC por un período de hasta seis meses y a temperatura ambiente durante 12 horas.
Según DHL, el brazo logístico de Deutsche Post, calcula que el mundo manejará unos 10.000 millones de dosis de varias vacunas contra el coronavirus para finales de 2021. Se estima que 3.000 millones de ellas utilizarán la novedosa tecnología de ARN mensajero que requiere un almacenamiento ultrafrío. El transporte de toda la carga podría implicar 15.000 vuelos y 15 millones de cajas refrigerantes especiales. En la historia se han construido aproximadamente 1.600 Boeing 747 y la IATA estima que se necesitan 8.000 de carga para atender el transporte de la vacuna.
Las aseguradoras enfrentarán la difícil tarea de cuantificar los riesgos de esta cadena de abastecimiento, debido a que las vacunas son un producto liviano con un alto valor monetario y además es la primera vez que se utilizaría el ARN mensajero.
Este desafío es una oportunidad para el negocio logístico y sus compañías involucradas de acuerdo al diario Cinco Días. Las compañías que fabrican congeladores superfríos comenzaron a prepararse hace meses. Los fabricantes de gases para condiciones de frío extremo y hielo seco también podrían tener mayor demanda de sus productos. Las acciones de la francesa Air Liquide han subido un 10% este mes; su rival Linde ha ganado un 16%.
Las compañías de transporte son otra pieza del rompecabezas de las vacunas. Kuehne+Nagel, el grupo suizo de logística con un valor de 25.000 millones de dólares, dijo en septiembre que había abierto dos instalaciones con temperatura controlada en Bruselas y Johannesburgo en previsión del aumento de la demanda de distribución de vacunas. DHL, que cuenta con unos 9.000 empleados capacitados para realizar transporte médico sensible, y sus rivales FedEx y United Parcel Service también están calentando motores.
Según recomendaciones de SpotSee, la solución más segura y rentable para el transporte de la vacuna es utilizar un monitor electrónico para el envío a un punto de distribución importante, con indicadores de tiempo y temperatura colocados estratégicamente dentro de la carga. La ubicación estratégica permite a quienes reciben la vacuna determinar si los productos en el centro de la carga mantienen la temperatura incluso si los que están en los bordes exteriores experimentaron cambios.
Luego, cuando el paquete a granel se divide en pequeñas cantidades para su envío a clínicas y farmacias individuales, los indicadores de tiempo y temperatura son la mejor opción y la más rentable.
Conocer la duración del viaje, que muestran los indicadores de tiempo y temperatura, permite al fabricante determinar con mayor precisión la seguridad y la potencia de la vacuna. Debido a que incluso las vacunas ultracongeladas se descongelan antes de la administración, una variación de temperatura puede significar simplemente que un envío en particular no se ve afectado, pero que debe usarse dentro de un cierto período de tiempo, generalmente medido en horas.
Ya comenzó la carrera para conseguir más aviones de carga, más contenedores y camiones refrigerados, más pallets isotérmicos certificados, y más almacenes y compartimentos de última milla que ayuden a proteger la vacuna.
La noticias del desarrollo de la vacuna son alentadoras, aunque aún faltan varios meses para la producción y distribución de las mismas. Los cuidados que se han realizado hasta ahora como el uso adecuado del tapabocas, deberán mantenerse y en 2021 se espera que junto con la aplicación de las vacunas, la pandemia logré controlarse y el mercado vuelva a la normalidad.
[:en]Since the beginning of the COVID-19 pandemic, the need for vaccines against the SARS-CoV-2 virus has become clear, and different laboratories have begun their research since March. After the necessary human trials, the hope is it, perhaps over next few months, one or more of these candidate vaccines will prove to be safe and cost-effective in responding to the pandemic. At that time, however, market and logistics chain will face another challenge: how to manufacture and distribute enough quality vaccines to meet global demand.
Currently, contagions reported by Covid-19 worldwide exceed 55 million, while deaths already exceed 1.3 million, according to data collected by Johns Hopkins University. Finding a vaccine against the new coronavirus has become a top priority.
Under normal conditions the development of a vaccine extends over several years or even decades, but in the context of the current pandemic, unprecedented financial investments and scientific collaborations are changing the usual processes for vaccine development. This means some of the stages of the research and development process are carried out in parallel, while maintaining strict clinical and safety standards, according to the WHO.
As reported by the web portal checked, Vaccines are preparations intended to generate immunity against a disease by stimulating the production of antibodies. Its function is to train and prepare the body’s natural defenses (the immune system) to detect and fight viruses and bacteria. If the body is subsequently exposed to these pathogens, it will be ready to destroy them immediately, thus preventing the disease.
According to RTVE, before any clinical trial in humans, the vaccine candidate must pass a Phase 0 or preclinical, which includes in vitro and animal tests. The vaccine must show that it is safe and works in animal organisms. If it does, it can move to the human clinical trial, which is further divided into three phases, with an additional fourth phase once the drug is already authorized and marketed:
Phase 1: The vaccine is tested in small groups of 20 to 100 healthy people. The study focuses on confirming that it is safe and the kind of immune response it generates, identifying already possible side effects and determining the appropriate dose.
Phase 2: A larger-scale study involving several hundred people. The most common short-term side effects and how the immune system evolves are evaluated here.
Phase 3: A much larger trial involving several thousand volunteers, who are already exposed to the virus. There is a control group, which is given placebo, and it compares how the people who were vaccinated with those who were not, while collecting statistical data about effectiveness and safety. It also serves to detect other possible side effects that have gone unnoticed in phase 2.
Phase 4: Vaccines undergo a new evaluation phase after they have been approved and marketed. The aim is to continue to gather information that can enhance their safety and effectiveness, with a much larger sample of people. Here, adverse effects may appear that have not been seen in previous phases, precisely because they are less frequent.
Of the 214 experimental vaccines under way against COVID-19, WHO recognizes 164 projects that have already found a vaccine candidate and are in the preclinical phase. In addition, there are 48 others who have passed and are in clinical phase, with human tests. Of these, 11 are in phase 3.

Moderna (United States), Phase 3: This vaccine is based on messenger RNA combined with the genetic code of the virus, and Spain will participate in its production process. It is already in phase 3 of clinical trials. The US pharmaceutical company has just announced that it has an efficacy of 94.5%, according to an interim analysis carried out by the company itself. The biotech company will now apply for emergency authorization for use in the United States in «the coming weeks».
BioNTech / Pfizer (Germany / United States). Phase 3: This vaccine candidate is already in phase 3; with four variants, all based on synthetic messenger RNA. This multiple approach allows for a simultaneous evaluation to increase the chances of identifying the safest and most effective candidate.
Jenner Institute, University of Oxford (UK). Phase 3: In this project, the most important being carried out on European soil, the pharmaceutical company AstraZeneca also participates. It uses an attenuated version of the chimpanzee common cold virus, which is characterized by its safety. Recently, it has been known that this experimental vaccine not only generates an adequate immune response in the young population, but also in the elderly, the most vulnerable group. In addition, the adverse reactions have been even milder among older volunteers (in any case, no serious effects related to the administration of the drug have been observed in any group so far).
Janssen / Johnson & Johnson (United States). Phase 3: Its Ad26 vaccine. COV2-S is based on a non-replicative recombinant adenovirus that is capable of generating an immune response to the coronavirus S protein (from ǐspike’, also called «espiga» in Spanish). The company believes that, if it continues to obtain the same satisfactory results, it may be on the market by early 2021.
Novavax (United States). Phase 3: After announcing that its vaccine candidate has shown a positive immune response, while it has barely caused side effects in most participants, the US biotech company has just begun the critical phase 3 of the tests.
Bharat Biotech (India). Phase 3: Named ‘Covaxine’, this experimental vaccine developed in India, one of the countries most affected by the pandemic, has just begun phase 3 of clinical trials. This candidate is based on an inactivated strain of the SARS-CoV-2 coronavirus, the cause of COVID-19 disease.
Sinovac (China). Phase 3: This Chinese proposal is based on purified inactive viruses and has generated many expectations. Phase 3 began weeks ago, after Brazil gave the go-ahead for the company to inoculate thousands of volunteers from the South American country with the experimental vaccine.
Sinopharm / Wuhan Institute of Biological Products and Sinopharm / Beijing Institute of Biological Products (both in China). Phase 3: China is also developing these two very promising stand-alone projects. Both are based on inactivated viruses and behind them is Sinopharm, the state-owned pharmaceutical giant. They are also in the final phase of clinical trials.
Gamaleya Research Institute (Russia). Phase 3: Named after the symbolic name of ‘Sputnik V’, it is a combined vector vaccine, and the Russian Ministry of Defense is also involved in its development. WHO has recognized the third phase of clinical trials, but the Russian Government has authorized their administration and has developed it after less than two months of voluntary testing and without having completed clinical trials.
CanSino Biological Inc. / Biotechnology Institute Beijing (China). Phase 3: This is a viral vector vaccine. Being also a subunit vaccine -a new generation formula that does not contain pathogens-, it is characterized by its safety. Due to the good expectations it is generating, the Chinese State Intellectual Property Office (SIPO) has approved its patent, so it could «be mass produced in a short period of time». It began testing at the end of June in the Chinese Army. The results of the second phase of clinical trials of the vaccine demonstrated that it is safe and induces immune response against coronavirus, according to research published in late July in the journal The Lancet.
On November 9, the pharmaceutical company Pfizer announced an effectiveness in its vaccine of 90% and on November 16 Moderna in a statement stated 94.5% effectiveness in its product. This information corresponds to preliminary information, so it would be a few months before its manufacture and distribution.
These announcements were enthusiastically received at the global level and represent a significant step forward in the race to fight the pandemic. It is important to make a comparison of these two vaccines that use messenger RNA for their development. According to data provided by Bloomberg and The Republic:
How are the results compared?
Moderna said Monday that its vaccine was 94.5% effective in a preliminary analysis. This compares favorably with the high level achieved a week earlier by Pfizer and its partner, BioNTech SE. The injection created by US and German companies was found to be more than 90% effective. Data from Moderna showed that side effects were generally short-lived and there were no significant safety concerns, while no serious cases of covid developed among the trial participants who received the vaccine. US regulators released a guide earlier this year saying that any shot should be at least 50% effective.
What do the two vaccines have in common?
Both injections are based on a technology called messenger RNA that has never been used to develop an approved vaccine before. The approach is designed to transform the body’s own cells into vaccine manufacturing factories. Vaccines instruct cells to make copies of the coronavirus’s peak protein, stimulating the creation of protective antibodies.

How do they differ?
Moderna received $955 million from the US Operation Warp Speed program. Pfizer has said it did not receive any federal funding to develop its vaccine, although BioNTech received up to €375 million (US$444 million) in aid from the German government. Still, Pfizer has reached a supply agreement with the U.S. worth nearly $2 billion. The United States agreed to pay up to US$1.53 billion to purchase supplies from the Modern takeover.
What are the challenges of storage and distribution?
Once vaccines are approved, the effort to immunize hundreds of millions of people will have to overcome several other obstacles. The storage and distribution of some of the products is complex. Pfizer vaccine should be stored ultra-cold for up to a few days before use but can be kept at refrigerator temperature for up to five days. Moderna, for its part, noted new data showing that vaccine is stable at refrigerator temperature for 30 days, much more than the seven days previously estimated. It can be kept in freezers longer term and does not need the special facilities needed for the Pfizer vaccine.
When could they be ready to deploy?
The results are preliminary, but both Moderna and Pfizer are expected to apply for emergency use authorization from the US Food and Drug Administration. If a further check shows that vaccines are safe. Moderna said she could apply for regulatory clearance in the coming weeks. Pfizer expects to get two months of security tracking data in the third week of November. If all goes well, Pfizer could apply for an authorization in the U.S. this month.
Vaccine Distribution and the Challenge to Logistics
If vaccines are approved for widespread use according to The Economist, the world will face what some have called the biggest supply chain challenge in history.
Pfizer says it will only be able to produce enough vaccine to inoculate 25 million people by 2020. Up to 1.3 billion doses are possible, in theory, next year, enough for another 650 million people. Moderna said it would have 20 million doses ready by the end of 2020 and between 500 to 1 billion by 2021. If other vaccines are approved, the supply will increase. However, even in the most optimistic scenarios demand is expected to exceed supply in 2021.
Delivering COVID-19 vaccines to 7.8 billion people is an overwhelming challenge that will push supply chains beyond their limits. Even if all the necessary doses were ready today, vaccine manufacturers still need to find solutions to deliver multiple doses of those vaccines to most people on the planet.
Last mile delivery is the biggest hurdle. As shipments of vaccines are divided into smaller units for shipment to hospitals, clinics, pharmacies and medical offices, it becomes increasingly difficult to ensure temperature stability over time.
Pfizer’s vaccine, by its characteristics, is required to be kept at temperatures as cold as -70º until the moment of its injection. A situation that would determine a problem at the time of its distribution, because the molecule of the vaccine is very fragile, and the slightest interruption of the cold chain can affect its effectiveness.
For its part, the Moderna vaccine would be much easier to keep and distribute to the different countries to begin vaccination to the population. The pharmacist reports that its vaccine, ‘mRNA-1273’, can be kept «between 2° and 8°, the temperature of a standard household refrigerator, for 30 days». They even ensure that it can be stored at -20ºC for a period of up to six months and at room temperature for 12 hours.
According to DHL, the logistics arm of Deutsche Post, estimates that the world will handle about 10 billion doses of several coronavirus vaccines by the end of 2021. It is estimated that 3 billion of them will use the innovative messenger RNA technology that requires ultra-cold storage. The transport of all cargo could involve 15,000 flights and 15 million special refrigerant boxes. In history, approximately 1,600 Boeing 747s have been built and IATA estimates that 8,000 loads are needed to transport the vaccine.
Insurers will face the difficult task of quantifying the risks of this supply chain because vaccines are a lightweight product with a high monetary value, and it is also the first time that messenger RNA would be used.
This challenge is an opportunity for the logistics business and its involved companies according to the daily Cinco Días. The companies that make superfast freezers started preparing months ago. Manufacturers of gases for extreme cold and dry ice conditions could also have higher demand for their products. France’s Air Liquide shares have risen by 10% this month; rival Linde has won 16%.
Transportation companies are another piece of the vaccine puzzle. Kuehne+Nagel, the Swiss logistics group worth $25 billion, said in September that it had opened two temperature-controlled facilities in Brussels and Johannesburg in anticipation of increased demand for vaccine distribution. DHL, which has about 9,000 staff trained to perform sensitive medical transport, and its FedEx and United Parcel Service rivals are also heating engines.
According to SpotSee’s recommendations, the safest and most cost-effective solution for transporting the vaccine is to use an electronic monitor for sending to a major distribution point, with time and temperature indicators strategically placed inside the load. The strategic location allows those receiving the vaccine to determine if the products in the center of the charge maintain the temperature even if those on the outer edges experienced changes.
Then, when the bulk package is divided into small quantities for shipment to individual clinics and pharmacies, time and temperature indicators are the best option and the most cost-effective.
Knowing the duration of the trip, which shows the time and temperature indicators, allows the manufacturer to more accurately determine the safety and potency of the vaccine. Because even deep-frozen vaccines defrost before administration, a temperature variation can simply mean that a shipment is not affected but must be used within a certain period, usually measured in hours.
The race to get more cargo planes, more containers and refrigerated trucks, more certified isothermal pallets, and more last-mile warehouses and compartments to help protect the vaccine has already begun.
The news of the development of the vaccine is encouraging, although the production and distribution of the vaccine are still several months away. The care that has been done so far, such as the proper use of the mask, must be maintained and in 2021 it is expected that along with the application of vaccines, the pandemic will be brought under control and the market will return to normal.
[:pb]Desde o início da pandemia da COVID-19, tornou-se necessário a busca de vacinas contra o vírus SARS-CoV-2, motivo pelo qual diversos laboratórios iniciaram suas pesquisas em março. Após os testes necessários em humanos, a esperança é que – talvez nos próximos meses – uma ou mais dessas vacinas candidatas se mostrem seguras e com boa relação custo-benefício na resposta à pandemia. Quando este momento chegar, o mercado e a cadeia logística terão outro desafio: como fabricar e distribuir vacinas de qualidade suficiente para atender à demanda global.
Atualmente, os contágios declarados pela Covid-19 em todo o mundo ultrapassam 55 milhões, enquanto as mortes já ultrapassam 1,3 milhão, segundo dados compilados pela Universidade Johns Hopkins. Encontrar uma vacina contra o novo coronavírus tornou-se uma questão da mais alta prioridade.
Em condições normais, o desenvolvimento de vacinas se estende por vários anos ou mesmo décadas, mas no contexto da atual pandemia, os investimentos financeiros e as colaborações científicas sem precedentes estão mudando os processos usuais de desenvolvimento de vacinas. Isso significa que algumas das fases do processo de pesquisa e desenvolvimento decorrem em paralelo, mantendo rígidos padrões clínicos e de segurança, de acordo com a OMS.
Conforme relatado pelo portal da web chequeado, as vacinas são preparações destinadas a gerar imunidade contra uma doença, estimulando a produção de anticorpos. Sua função é treinar e preparar as defesas naturais do corpo (o sistema imunológico) para detectar e combater vírus e bactérias. Se o corpo for subsequentemente exposto a esses patógenos, estará pronto para destruí-los imediatamente, evitando doenças.
De acordo com a RTVE antes de qualquer ensaio clínico em humanos, a vacina candidata deve passar pela Fase 0 ou pré-clínica, que inclui testes in vitro e em animais. A vacina deve mostrar que é segura e que funciona em organismos animais. Se esse processo for feito, será possível passar para o ensaio clínico em humanos, que é dividido em três fases, com uma quarta fase adicional assim que o medicamento for licenciado e comercializado:
Fase 1: A vacina é testada em pequenos grupos de 20 a 100 pessoas saudáveis. O estudo se concentra em confirmar se é seguro e o tipo de resposta imune que gera, identificando possíveis efeitos colaterais e determinando a dose adequada.
Fase 2: É um estudo em grande escala envolvendo várias centenas de pessoas. Aqui, os efeitos colaterais mais comuns em curto prazo e como o sistema imunológico evolui são avaliados.
Fase 3: É um ensaio muito maior envolvendo vários milhares de voluntários, que já estão expostos ao vírus. Existe um grupo de controle, ao qual é administrado um placebo, e como as pessoas que foram vacinadas são comparadas com as que não foram, ao mesmo tempo em que são coletados dados estatísticos sobre a eficácia e segurança. Também é usado para detectar outros possíveis efeitos colaterais que podem ter passado despercebidos na fase 2.
Fase 4: As vacinas passam por uma nova fase de avaliação após serem aprovadas e comercializadas. O objetivo é continuar coletando informações que possam reforçar sua segurança e eficácia, com uma amostra muito maior de pessoas. Aqui podem surgir efeitos adversos não vistos nas fases anteriores, justamente por serem menos frequentes.
Das 214 vacinas experimentais em andamento contra a COVID-19, a OMS reconhece 164 projetos que já encontraram uma vacina candidata e estão em fase pré-clínica. Além disso, há outros 48 que passaram e estão em fase clínica, com testes em humanos. Onze deles estão na fase 3, antes da comercialização:

Relatorio de RTVE :
Moderna (Estados Unidos), Fase 3: Esta vacina é baseada no RNA mensageiro combinado com o código genético do vírus, e a Espanha participará de seu processo de produção. Já está na fase 3 dos ensaios clínicos. A farmacêutica americana acaba de anunciar que é 94,5% eficaz, segundo análise intermediária realizada pela própria empresa. A biotecnologia agora solicitará uma autorização de emergência para uso nos Estados Unidos nas “próximas semanas”.
BioNTech / Pfizer (Alemanha / Estados Unidos). Fase 3: Esta vacina candidata já está na fase 3; com quatro variantes, todas baseadas em RNA mensageiro sintético. Essa abordagem múltipla permite uma avaliação simultânea para aumentar as chances de identificar o candidato mais seguro e eficaz.
Instituto Jenner da Universidade de Oxford (Reino Unido). Fase 3: Neste projeto, o mais importante que está sendo executado em solo europeu, participa também a farmacêutica AstraZeneca. Ele usa uma versão atenuada do vírus do resfriado comum do chimpanzé, que é conhecido por sua segurança. Recentemente, soube-se que esta vacina experimental não só gera uma resposta imunológica adequada na população jovem, mas também nos idosos, o grupo mais vulnerável. Além disso, as reações adversas foram ainda mais leves entre os voluntários mais velhos (em todo caso, nenhum efeito relacionado ao medicamento foi relatado até o momento em nenhum grupo).
Janssen / Johnson & Johnson (Estados Unidos). Fase 3: Sua vacina Ad26.COV2-S é baseado em um adenovírus recombinante não replicativo que é capaz de gerar uma resposta imune contra a proteína S do coronavírus ( “spike”). A empresa acredita que, se continuar obtendo os mesmos resultados satisfatórios, poderá estar no mercado no início de 2021.
Novavax (Estados Unidos). Fase 3: Depois de anunciar que sua vacina candidata mostrou uma resposta imunológica positiva e causando poucos efeitos colaterais na maioria dos participantes, a empresa americana de biotecnologia acaba de iniciar os testes críticos de fase 3.
Bharat Biotech (Índia). Fase 3: Batizada de “Covaxine”, essa vacina experimental que está sendo desenvolvida na Índia, um dos países mais afetados pela pandemia, acaba de iniciar a fase 3 dos testes clínicos. Este candidato é baseado em uma cepa inativada do coronavírus SARS-CoV-2, a causa da doença COVID-19.
Sinovac (China). Fase 3: Esta proposta chinesa é baseada em vírus inativos purificados e gerou muitas expectativas. A fase 3 começou há semanas, depois que o Brasil deu sinal verde para que a empresa inoculasse a vacina experimental em milhares de voluntários do país sul-americano.
Sinopharm / Instituto de Produtos Biológicos de Wuhan e Sinopharm / Instituto de Produtos Biológicos de Pequim (ambos na China). Fase 3: A China também está desenvolvendo esses dois projetos independentes e muito promissores. Ambos são baseados em vírus inativados e por trás deles está a Sinopharm, a gigante farmacêutica estatal. Eles também estão na última fase de testes clínicos.
Instituto de Pesquisa Gamaleya (Rússia). Fase 3: Batizada com o nome simbólico de “Sputnik V”, é uma vacina de vetor combinada, e o Ministério da Defesa da Rússia também participa de seu desenvolvimento. A OMS reconheceu a terceira fase dos ensaios clínicos, mas o Governo russo autorizou a sua administração e considera-a concluída, após menos de dois meses de testes com voluntários e sem ter concluído os ensaios clínicos.
CanSino Biological Inc. / Instituto de Biotecnologias de Pequim (China). Fase 3: É uma vacina de vetor viral. Por ser também uma vacina de subunidade – uma fórmula de nova geração que não contém patógenos – caracteriza-se por sua segurança. Devido às boas expectativas que está gerando, o Escritório de Propriedade Intelectual do Estado Chinês (SIPO) aprovou sua patente, para que pudesse “ser produzida em massa em um curto período de tempo”. Ela começou a ser testado no final de junho no Exército Chinês. Os resultados da segunda fase de testes clínicos da vacina mostraram que ela é segura e induz uma resposta imune contra o coronavírus, segundo pesquisa publicada no final de julho no The Lancet.
Em 9 de novembro, a farmacêutica Pfizer anunciou 90% de eficácia em sua vacina e em 16 de novembro a Moderna em comunicado afirmou 94,5% de eficácia em seu produto. Essas informações correspondem a informações preliminares, portanto, seriam alguns meses antes de sua fabricação e distribuição.
Esses anúncios foram recebidos com entusiasmo em todo o mundo e marcaram um avanço significativo na corrida para combater a pandemia. É importante fazer uma comparação entre essas duas vacinas que utilizam RNA mensageiro para seu desenvolvimento. De acordo com dados fornecidos por Bloomberg e a República:
Como os resultados são comparados?
A Moderna disse na segunda-feira que sua vacina foi 94,5% eficaz em uma análise preliminar. Isso se compara favoravelmente com o alto nível alcançado uma semana antes pela Pfizer e seu parceiro, BioNTech SE. A injeção criada pelas empresas americanas e alemãs foi considerada mais de 90% eficaz. Os dados da Moderna mostraram que os efeitos colaterais geralmente duram pouco e não há problemas de segurança significativos, enquanto nenhum caso grave de covid se desenvolve entre os participantes do ensaio que receberam a vacina. Os reguladores dos EUA publicaram orientações no início deste ano dizendo que qualquer injeção deve ser pelo menos 50% eficaz.
O que as duas vacinas têm em comum?
Ambas as injeções são baseadas em uma tecnologia chamada RNA mensageiro, que nunca foi usada antes para desenvolver uma vacina aprovada. A abordagem é projetada para transformar as próprias células do corpo em fábricas de vacinas. As vacinas instruem as células a fazer cópias da proteína do “spike” do coronavírus, estimulando a criação de anticorpos protetores.

Qual a diferença entre elas?
A Moderna recebeu US $ 955 milhões do programa Operation Warp Speed dos Estados Unidos. A Pfizer disse que não recebeu nenhum financiamento federal para desenvolver sua vacina, embora a BioNTech tenha obtido até 375 milhões de euros (US $ 444 milhões) em ajuda do governo alemão. Mesmo assim, a Pfizer chegou a um acordo de fornecimento com os EUA por um valor de quase US $ 2 bilhões. Os Estados Unidos concordaram em pagar até US $ 1,53 bilhão para comprar suprimentos do outlet Moderna.
Quais são os desafios de armazenamento e distribuição?
Assim que as vacinas forem aprovadas, o esforço para imunizar centenas de milhões de pessoas terá que superar uma série de outros obstáculos. O armazenamento e distribuição de alguns dos produtos é complexo. A vacina Pfizer deve ser armazenada em ultrafrio por alguns dias antes do uso, mas pode ser mantida em temperatura de geladeira por até cinco dias. A Moderna, por sua vez, apontou novos dados que mostram que sua vacina é estável em temperatura de geladeira por 30 dias, muito mais do que os sete dias estimados anteriormente. Ela pode ser armazenada em freezers por um longo prazo e não requer as instalações especiais exigidas para a vacina Pfizer.
Quando elas podem estar prontos para aplicação?
Os resultados são preliminares, mas tanto a Moderna quanto a Pfizer devem solicitar autorização de uso emergencial da Administração de Drogas e Alimentos dos EUA. Se uma revisão posterior mostrar que suas vacinas são seguras. A Moderna disse que pode solicitar autorização dos reguladores nas próximas semanas. A Pfizer espera obter dois meses de dados de monitoramento de segurança na terceira semana de novembro. Se tudo correr bem, a Pfizer pode solicitar uma autorização nos Estados Unidos neste mês.
Distribuição de vacinas e o desafio da logística
Se as vacinas forem aprovadas para uso generalizado de acordo com The Economist , o mundo enfrentará o que alguns chamam de o maior desafio da cadeia de suprimentos da história.
A Pfizer diz que só será capaz de produzir vacina suficiente para inocular 25 milhões de pessoas em 2020. Até 1,3 bilhão de doses são teoricamente possíveis no próximo ano, o suficiente para outros 650 milhões de pessoas. A Moderna disse que terá 20 milhões de doses prontas até o final de 2020 e entre 500 a 1 bilhão em 2021. Se outras vacinas forem aprovadas, o fornecimento aumentará. No entanto, mesmo nos cenários mais otimistas, espera-se que a demanda exceda a oferta ao longo de 2021.
Distribuir vacinas contra a COVID-19 para 7,8 bilhões de pessoas é um desafio assustador que levará as cadeias de abastecimento a ultrapassar seus limites. Mesmo que todas as doses necessárias estivessem prontas hoje, os fabricantes de vacinas ainda precisam encontrar soluções para administrar doses múltiplas dessas vacinas para a maioria das pessoas no planeta.
Cumprir a última milha é o maior obstáculo. Como as remessas de vacinas são divididas em unidades menores para remessa a hospitais, clínicas, farmácias e consultórios médicos, está se tornando cada vez mais difícil garantir a estabilidade da temperatura ao longo do tempo.
A vacina da Pfizer, devido às suas características, deve ser mantida em temperaturas de até -70º até o momento da injeção. Situação que determinaria um problema no momento de sua distribuição, pois a molécula da vacina é muito frágil e a menor interrupção da cadeia de frio pode afetar sua eficácia.
Por sua vez, a vacina Moderna seria muito mais fácil de preservar e distribuir aos diferentes países para começar a vacinar a população. A empresa farmacêutica relata que sua vacina “mRNA-1273”; pode ser mantida “entre 2 ° e 8 °, a temperatura de um refrigerador doméstico padrão, por 30 dias”. Eles afirmam ainda que pode ser armazenado a -20ºC por um período de até seis meses e em temperatura ambiente por 12 horas.
De acordo com a DHL, o braço de logística do Deutsche Post, estima-se que o mundo vai lidar com cerca de 10 bilhões de doses de várias vacinas contra o coronavírus até o final de 2021. 3 bilhões deles usarão a nova tecnologia de RNA mensageiro que requer armazenamento ultrafrio. O transporte de toda a carga pode envolver 15 mil voos e 15 milhões de caixas frigoríficas especiais. Na história, aproximadamente 1.600 Boeing 747s foram construídos e a IATA estima que 8.000 cargas sejam necessárias para lidar com o transporte da vacina.
As seguradoras enfrentarão a difícil tarefa de quantificar os riscos dessa cadeia de suprimentos, já que as vacinas são um produto leve e de alto valor monetário e também é a primeira vez que o RNA mensageiro seria utilizado.
Este desafio é uma oportunidade para o negócio de logística e suas empresas envolvidas, segundo o jornal Cinco Días. As empresas que fabricam freezers superfrios começaram a se preparar há meses. Os fabricantes de gases para condições de frio extremo e gelo seco também podem ter maior demanda por seus produtos. As ações da francesa Air Liquide subiram 10% este mês; seu rival Linde ganhou 16%.
As empresas de transporte são outra peça do quebra-cabeça das vacinas. Kuehne + Nagel, o grupo de logística suíço de US $ 25 bilhões, disse em setembro que havia aberto duas instalações com temperatura controlada em Bruxelas e Joanesburgo em antecipação ao aumento da demanda por distribuição de vacinas. A DHL, que tem cerca de 9.000 funcionários treinados para lidar com transportes médicos confidenciais, e os rivais FedEx e United Parcel Service também estão se aquecendo.
De acordo com as recomendações do SpotSee, a solução mais segura e econômica para o transporte de vacinas é usar um monitor eletrônico para envio a um ponto de distribuição principal, com indicadores de tempo e temperatura estrategicamente colocados dentro da carga. A localização estratégica permite que os destinatários da vacina determinem se os produtos no centro da carga estão mantendo a temperatura, mesmo que aqueles nas bordas externas tenham mudado.
Então, quando a embalagem a granel é dividida em pequenas quantidades para envio a clínicas e farmácias individuais, os indicadores de tempo e temperatura são a melhor opção e a mais econômica.
Saber a duração da viagem, mostrada pelos indicadores de tempo e temperatura, permite ao fabricante determinar com mais precisão a segurança e a potência da vacina. Como mesmo as vacinas ultracongeladas são descongeladas antes da administração, uma variação na temperatura pode simplesmente significar que um determinado carregamento não foi afetado, mas que deve ser usado dentro de um certo período de tempo, geralmente medido em horas.
Começou a corrida por mais aviões de carga, mais contêineres e caminhões refrigerados, mais paletes isolados certificados e mais depósitos e compartimentos de última milha para ajudar a proteger a vacina.
A notícia do desenvolvimento da vacina é animadora, embora ainda faltem vários meses para a produção e distribuição da mesma. Os cuidados até agora realizados, como o uso adequado da máscara, devem ser mantidos e em 2021 a previsão é que junto com a aplicação das vacinas, a pandemia seja controlada e o mercado volte ao normal.
[:].